技术专题
慢病毒包装经典文献解析
文章来源:genecreate
作者:genecreate
发布时间:2018-08-29 17:30
病毒包装是生物医学研究中的一大利器,通过病毒可以高效地让要研究的基因在目标细胞中过表达或者特异性地敲低细胞中的目标基因。慢病毒(Lentivirus)是逆转录病毒的一种,慢病毒载体是以HIV-1(人类免疫缺陷1型病毒)为基础发展起来的病毒载体。慢病毒载体系统包含了包装、转染、稳定整合所需要的遗传信息,无需任何转染试剂,操作简便,已广泛应用于基因治疗、药物研究、快速建立生产目的蛋白细胞系等方面。
这里,小编以一篇经典文献带您了解慢病毒包装在医学生物学中的应用。
题目:EZH2 regulates neuroblastoma cell differentiation via NTRK1 promoter epigenetic modifications(EZH2通过NTRK1启动子的表观遗传修饰来调节神经母细胞瘤的细胞分化)
期刊:Oncogene
影响因子:6.854
发表时间:20180306
研究背景:
神经母细胞瘤(NB)是源于交感神经系统的第二常见的固体恶性肿瘤。尽管目前针对NB可进行多种模式的综合治疗,神经母细胞瘤仍然是最难治愈的肿瘤之一,NB患者只有40%的存活率。EZH2是PcG蛋白家族的成员,在前列腺癌、乳腺癌、膀胱癌、胃癌等癌症细胞中EZH2的表达上调。虽然最近已经开发出EZH2的抑制剂,然而它们在这些恶性肿瘤中的有效性和分子作用机制尚未被阐明,目前的研究也尚未对EZH2的突变功能进行报道。已有研究表明,表观遗传修饰(如CASP8启动子甲基化和CpG岛甲基化)对NB的肿瘤发生和侵袭具有一定影响。为了阐明EZH2在NB肿瘤发生中的功能,本文使用慢病毒系统对NB细胞中的EZH2表达进行干扰,结合多项实验技术获得的结果表明EZH2在预防NB细胞分化中发挥重要作用,且EZH2相关的NTRK1转录调控可能是NB细胞分化的关键途径。
研究内容及结果:
1 敲降EZH2促进NB细胞的分化
采用shEZH2慢病毒感染NB-39-nu细胞后,发现EZH2的敲降能够强烈地促进神经突触延伸,并且神经元细胞分化标记蛋白GAP43和NF68的表达均产生上调。随着shEZH2干扰作用的加强,受EZH2催化的H3K27三甲基化信号明显减少。裸鼠皮下成瘤的结果表明shEZH2稳定转化NB-39-nu细胞形成的肿瘤与对照组相比显著减小(图1)。
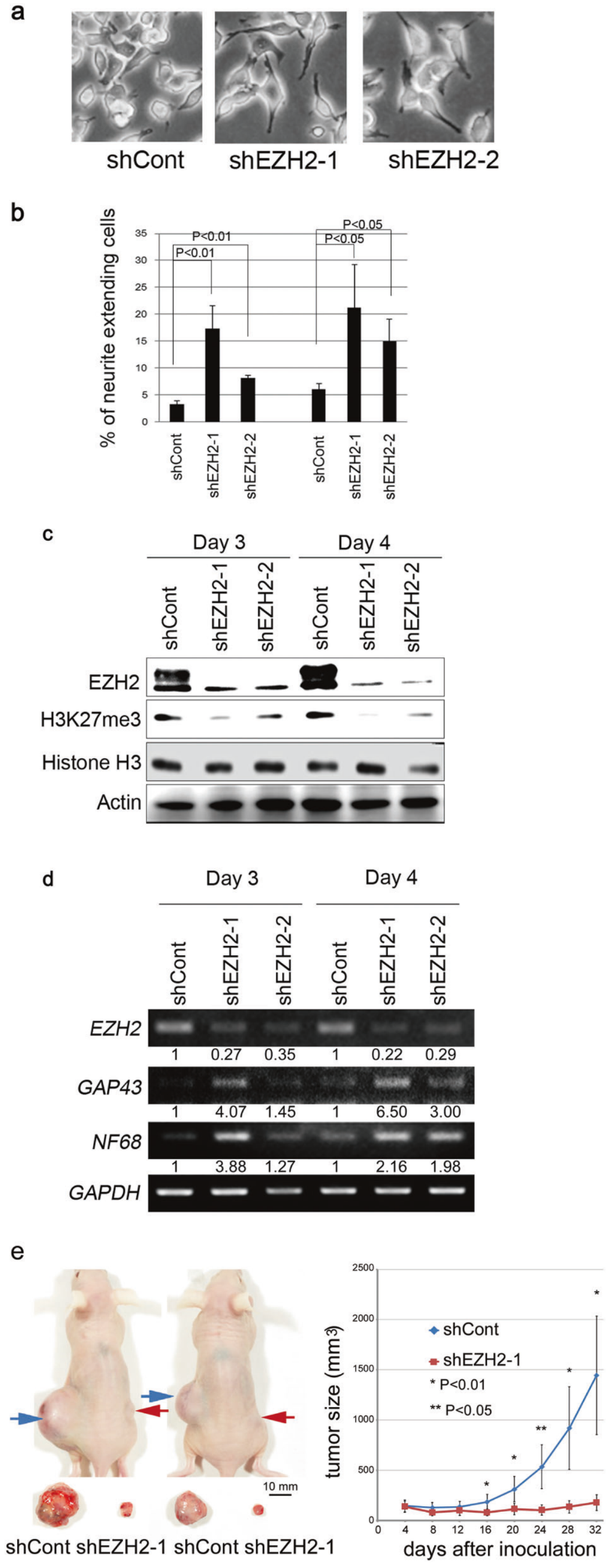
Fig. 1 Knockdown of EZH2 promotes neurite extension and induces
neuronal markers
2 EZH2敲低细胞的转录组分析
对shEZH2-NB-39-nu细胞进行转录组分析发现,表达显著上调的基因中很多涉及神经及凋亡相关通路。在这些基因中,作者将焦点关注在神经营养性酪氨酸激酶受体家族成员——NTRK1。通过RT-PCR、real-time PCR、Western blot以及免疫染色实验,作者证实在shEZH2-NB-39-nu细胞中NTRK1的表达上调(图2)。

Fig. 2 EZH2 depletion induces NTRK1
采用shEZH2慢病毒感染其他NB细胞系(NGP、SK-N-DZ和TGW)后,qPCR检测到NTRK1的表达上调,且NB细胞分化相关基因的表达也上调,显微镜下观察到细胞的神经突触延伸,进一步验证了在NB-39-nu细胞中获得的结果。以上数据表明EZH2是NB细胞分化的重要调控因子之一,且NTRK1是其靶标基因(图3)。

Fig. 3 EZH2 depletion promotes differentiation and induces NTRK1 in NB cells
3 EZH2甲基化酶抑制剂诱导NB细胞分化
为了验证EZH2小分子抑制剂是否具有类似EZH2 KD的效果,作者使用两种阻碍EZH2 H3K27甲基化但不会影响的其表达水平的抑制剂处理NB细胞,发现处理后的细胞中NTRK1的表达也受到诱导。但是抑制剂处理后对细胞神经突触延伸的影响较EZH2 KD轻微,表明EZH2在NB细胞去分化中的作用并不完全依赖于其甲基化活性(图4)。

Fig. 4 Treatments with EZH2 inhibitors induce NTRK1 expression
4 NTRK1促进EZH2调控的NB细胞分化
为了确定NTRK1是否有助于EZH2调控NB细胞分化,作者使用小干扰RNA来抑制shEZH2-NB细胞中NTRK1的表达。结果表明,NTRK1的敲低显著抑制了EZH2 KD诱导的NB细胞轴突延伸。而使用神经生长因子处理shEZH2-NB细胞后,轴突的延伸和神经元细胞分化标记蛋白的表达均增加,说明NTRK1能够促进EZH2调控的NB细胞分化(图5)。
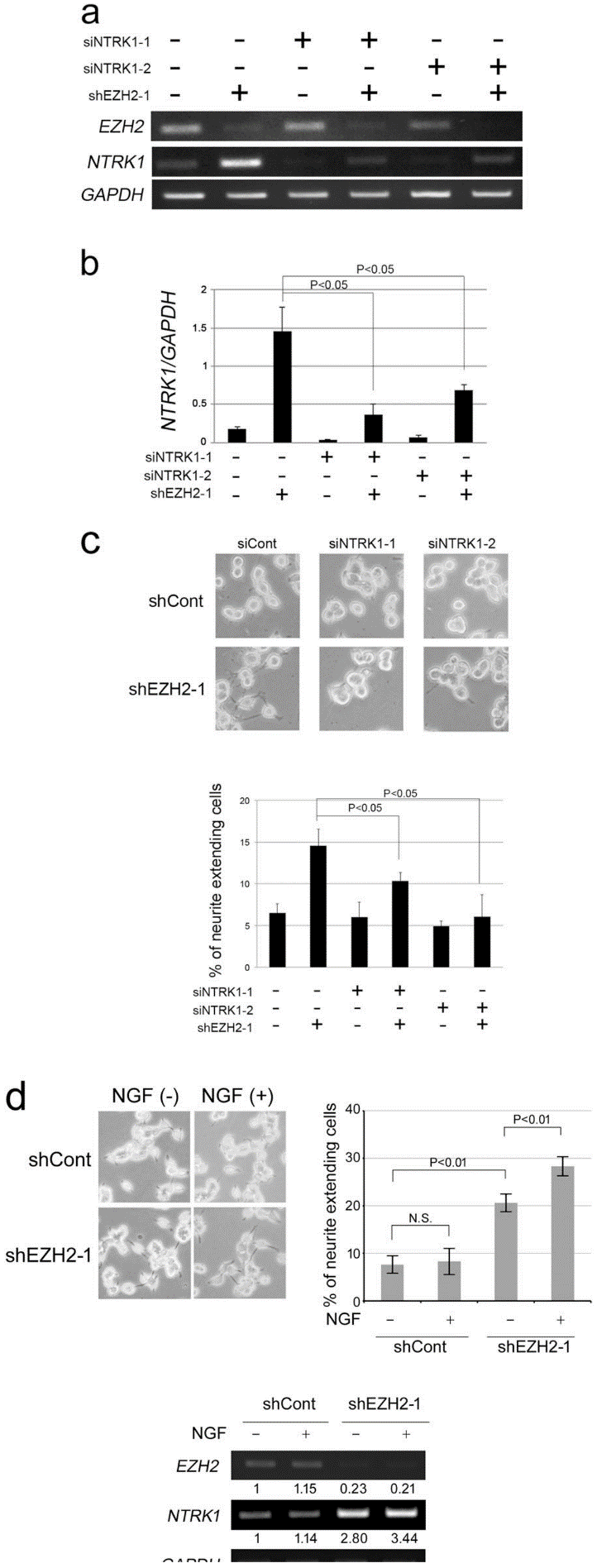
Fig. 5 EZH2 KD-induced neurite extension is canceled by the depletion of NTRK1
5 NTRK1的转录受到EZH2和DNA甲基化的调控
尽管已有的研究表明EZH2可通过其H3K27三甲基化活性导致基因沉默,但目前仍不清楚NTRK1的转录是否受EZH2的H3K27三甲基化调节。ChIP-qPCR实验表明EZH2能够与NTRK1的P1启动子区域特异性结合,而EZH2的敲低则显著降低了NTRK1 P1启动子区域的H3K27me3标记,使用EZH2甲基化酶抑制剂处理后也得到了类似的结果,表明EZH2通过与NTRK1的P1启动子区域结合,来直接调控NB细胞中NTRK1的转录(图6)。

Fig. 6 Complex epigenetic regulation of NTRK1 promoters by EZH2 and/or DNA methylation
文章小结:
本研究结果表明EZH2在预防NB细胞分化中发挥重要作用,且EZH2相关的NTRK1转录调控可能是NB细胞分化的关键途径,本文作者首次在NB细胞中证明了EZH2对NTRK1的表观遗传学调控。
解析文献:
Li Z1, Takenobu H, Setyawati AN, et al. EZH2 regulates neuroblastoma cell differentiation via
NTRK1 promoter epigenetic modifications. Oncogene. 2018;doi:10.1038.
参考文献:
Westermann F, Schwab M. Genetic parameters of neuroblastomas. Cancer Lett. 2002;184:127-47.
Peifer M, Hertwig F, Roels F, Dreidax D, Gartlgruber M, Menon R, et al. Telomerase activation by genomic rearrangements in high-risk neuroblastoma. Nature. 2015;526:700-4.
Pugh TJ, Morozova O, Attiyeh EF, Asgharzadeh S, Wei JS, Auclair D, et al. The genetic landscape of high-risk neuroblastoma. Nat Genet. 2013;45:279-84.
Kamijo T, Nakagawara A. Molecular and genetic bases of neuroblastoma. Int J Clin Oncol. 2002;17:190-5.
Teitz T, Wei T, Valentine MB, Vanin EF, Grenet J, Valentine VA, et al. Caspase 8 is deleted or silenced preferentially in childhood neuroblastomas with amplification of MYCN. Nat Med. 2000;6:529-35.