技术专题
ChIP(染色质免疫沉淀)实验心得
文章来源:genecreate
作者:genecreate
发布时间:2018-07-12 16:59
基于体内分析而发展的染色质免疫沉淀分析(Chromatin immunoprecipitation assay kit,ChIP)技术可以真实、完整地反映结合在DNA序列上的调控蛋白。由于ChIP采用甲醛固定活细胞或者组织的方法,因此能比较真实的反映细胞内TF与Promoter的结合情况,还可以用来研究组蛋白的各种共价修饰与基因表达的关系。近年来,这种技术得到不断的发展和完善。采用结合微阵列技术在染色体基因表达调控区域检查染色体活性,是深入分析癌症、心血管病以及中央神经系统紊乱等疾病主要通路的一种非常有效的工具。
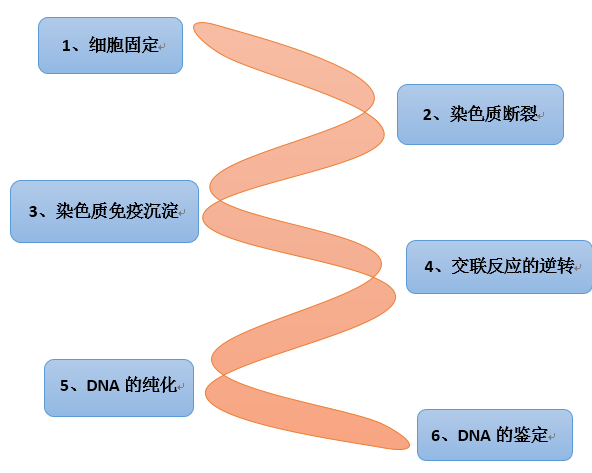
染色质免疫沉淀分析(ChiP)的基本原理是在活细胞状态下,当用甲醛处理时,相互靠近的蛋白与蛋白、蛋白与核酸(DNA或RNA)之间会产生共价键。细胞内,当TF与Promoter相互结合时,它们必然靠的比较近或者契合在一起,这个时候用甲醛处理,能使它们之间产生共价键。固定的蛋白质-DNA复合物通过超声或酶处理将其随机切断为一定长度范围内的染色质小片段,然后通过抗原抗体的特异性识别反应沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。通过qPCR或二代测序,筛选与目的蛋白互作的未知DNA信息。
今天小编将ChIP实验的一点心得体会拿出来与大家一同分享。
(一)关于细胞
细胞的生长状态要好。因为细胞的生长状态直接影响细胞内部的基因表达调控网络,也很有可能影响所研究的TF与其靶Promoter的结合。一般而言,细胞密度长到75%-80%比较好。
(二)关于抗体
抗体是实验成败的致命因素之一!必须是IP级别的抗体,单抗与多抗的选择也需要仔细考虑。单抗和多抗两种抗体各有利弊。单抗特异性强,背景低。但是单抗有一个弱点,就是识别位点单一,而在ChIP甲醛交联的过程中,很有可能该位点被其它蛋白或核酸结合而被封闭,导致单抗不能识别靶蛋白。多抗虽然没有这个问题,但是多抗特异性较差,背景可能会偏高。一般而言,如果没有十足把握,比如单抗的识别位点远离靶蛋白与核酸结合的区域),建议选择多抗比较稳妥一点。
(三)关于交联与超声破碎
交联与超声破碎的确是ChIP实验中比较难把握的部分。交联的程度会影响到超声破碎的效果,交联的程度越高,超声破碎就越不易把基因组打碎成小片段。交联不充分,只有一部分靶蛋白与其Promoter相结合,富集得到的Promoter的量不高,实验易出现假阴性。交联过充分,基因组上结合了太多的蛋白,对超声破碎造成障碍,另外也会增加背景。可以通过超声结果来判断超声效果,超声破碎后的DNA片段大小一般在100-500bp是效果比较好的,因为不同的样本交联时间和超声时间不同,可以提前通过预实验来确定。
一般来讲,根据经验,交联条件取决于细胞类型。不同的细胞系,交联的条件也不一样。例如,NIH-3T3的交联条件是室温(一般为25 ℃)下15min,1%的甲醛浓度,不同的细胞系则可能完全不一样。而超声破碎的条件,机器不一样,条件也不一样。
(四)关于操作
操作时,尽可能的保持低温(4度)。沉淀的时候可以先在4度放置一会,等它自然沉降一些,再超低转速(500 rpm等)离心使其完全沉降。虽然说明书上说ChIP实验的过程中有几个可以停顿的地方,但最好还是能够连续把它做完,直到PCR结果出来为止,尽量避免实验中不可预知的影响因素。
(五)关于解交联
一般说明书上会说4小时已经足够,但依据经验,可以解交联过夜。因为在这种的环境里,DNA不会降解,过夜解交联更充分。这里提醒一点,解交联过夜不要忘记在EP管口封上封口膜。
应用举例
题目:Hypoxia induces H19 expression through direct and indirect Hif-1α activity, promoting oncogenic effects in glioblastoma
期刊:scientific reports
主要结论:作者分别使用了两种细胞U87和U251,验证SP1对于H19的转录调控作用。用SP1抗体进行ChIP实验,对H19的启动子区域上游100bp的高GC含量,设计引物。富集到的DNA进行qPCR检测,结果显示SP1能够调控H19启动子的转录。
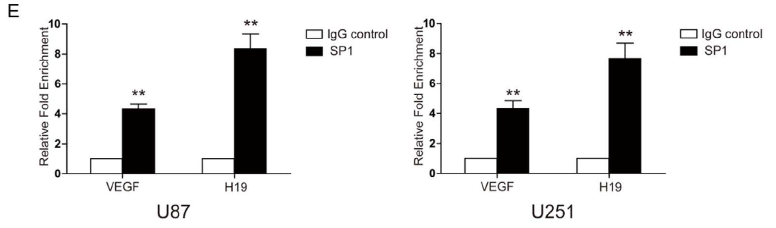
用SP1抗体进行ChIP实验,对H19启动子序列设计引物,富集的DNA进行qPCR检测