技术专题
如何利用CoIP-MS高效筛选体内互作蛋白
文章来源:genecreate
作者:genecreate
发布时间:2022-11-01 14:05
众所周知Co-IP(免疫共沉淀,co-inmunoprecipitation)是经典的利用抗体从样品中捕获靶蛋白及其互作蛋白、复合体的一项技术,能够特异性富集所研究的目的蛋白。由于过程中采用了非变性条件,保留了互作及复合体的细胞内状态。相对于酵母双杂交、pull down等方法,其特色之一便是捕获的蛋白互作发生在所研究的特定组织细胞内,保存了互作蛋白及复合体的“内源”状态。本文重在介绍Co-IP同蛋白质谱技术联用,进行高效筛选鉴定未知互作蛋白。
经典Co-IP流程在收集捕获产物之后,通过SDS-PAGE、银染分析差异条带、Western Blot来鉴定某些预设的互作蛋白。这种途径限于通量、抗体等因素,适合点对点验证。CoIP-MS即为将免疫共沉淀和蛋白质谱技术串联,运用LC-MS/MS技术对Co-IP所捕获的蛋白产物进行鉴定分析的技术。相比于MALDI-TOF, LC-MS/MS方法具有更高的灵敏度和几乎100%的可靠性,是主流文献中最常用的方法。
在对样本进行非变性条件的蛋白提取之后,Co-IP所获产物进行SDS-PAGE分离不同大小的蛋白,蛋白质还原烷基化及酶解,除盐之后的酶解产物进行LC-MS/MS鉴定,将下机数据进行数据库检索,获取产物中蛋白信息。之后再进一步进行对照组及样品组的韦恩分析,鉴定蛋白质的GO、COG和KEGG注释分析,以预测蛋白质的功能,揭示蛋白质在各个生命活动中的生物学意义。
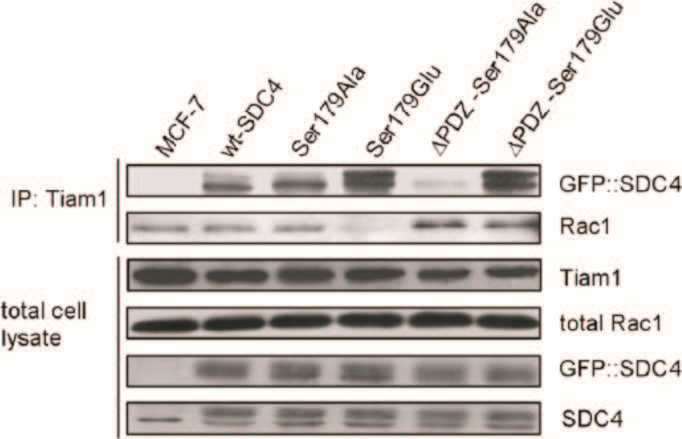
(引自Keller-Pinter A, Ughy B, Domoki M,et al. The phosphomimetic mutation of syndecan-4 binds and inhibits Tiam1 modulating Rac1 activity in PDZ interaction-dependent manner. PLoS One. 2017 Nov 9;12(11):e0187094.)
1. 样品蛋白提取
为了保持目的蛋白本身及其互作蛋白、复合体的天然状态,不遗漏互作蛋白信息,Co-IP样品的蛋白提取应注意:不使用SDS、Sodium deoxycholate等离子型去垢剂,不能使用尿素、硫脲等强变性剂,也不能经过丙酮/TCA沉淀等导致蛋白变性的有机试剂处理。只能使用如NP-40、Triton X-100等非离子型去垢剂。此外,包括冻融、超声处理等条件也会不同程度破坏蛋白复合物的存在状态。因此,如何既保护蛋白活性又获取较高的提取效率,需要借助经验及预实验来确定实验条件。
2. 免疫共沉淀Co-IP
在Co-IP过程中,除了所用抗体性能达到IP级别的亲和力是先决条件之外,孵育体系中的总蛋白浓度、抗体用量、漂洗条件等方面也决定Co-IP过程的灵敏度以及特异性。通常总蛋白浓度需要≥1mg/ml,当总蛋白浓度足够高时,可以适当倍数稀释样品以降低其中去垢剂浓度,为抗体反应提供温和环境。使用protein A/G的磁珠或凝胶时不宜贪多,目前商品化产品其载量都在50ul用量时承载50ug或更多抗体,而通常一个Co-IP反应的用量在1-3ug左右。漂洗缓冲液需要控制适当的盐离子强度、去垢剂种类及浓度,通常会延用裂解液缓冲液配方,因为背景蛋白在后续质谱过程中会干扰蛋白的鉴定,优化漂洗缓冲液的目的是既保持目的蛋白复合物的捕获效率又尽量减少非特异结合蛋白。
3. 质谱上机前样本处理
蛋白质还原烷基化和酶解。蛋白质的还原烷基化如下,加入二硫苏糖醇(DTT)还原蛋白质,再加入碘乙酸铵(IAM),最后加入Trypsin酶,过夜酶解,酶解后处理。酶解产生的多肽用C18柱子除盐,已经除盐的多肽抽干后用Loading Buffer (含甲酸、乙腈)溶解多肽。多肽上LC-MS/MS仪器进行分析,然后对结果进行评估。
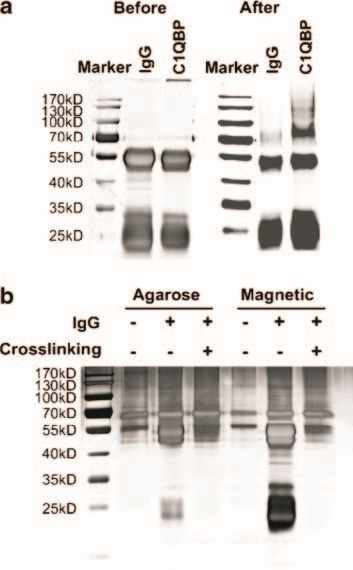
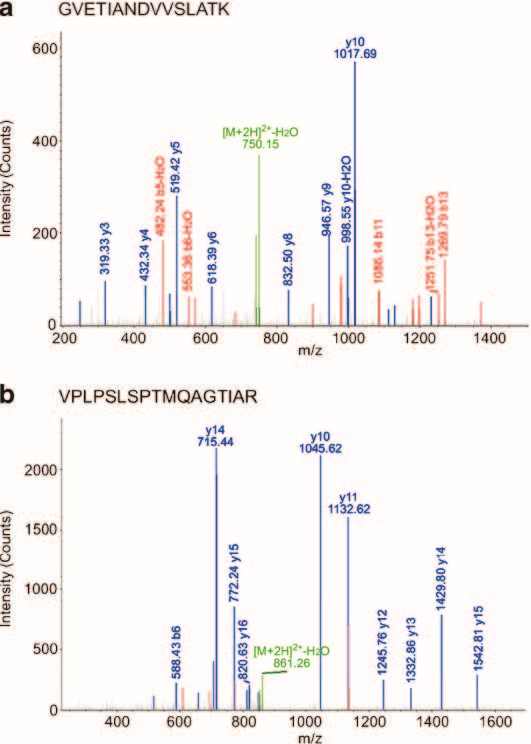
(引自Chen R, Xiao M, Gao H, et al. Identification of a novel mitochondrial interacting protein of C1QBP using subcellular fractionation coupled with CoIP-MS.[J]. Analytical & Bioanalytical Chemistry, 2016, 408(6):1557-1564.)
4. 数据检索、蛋白鉴定
LC-MS/MS下机后,将原始下载数据直接提交到与质谱仪连接的Proteinpilot软件中进行数据库检索,过滤掉常见污染蛋白及与之匹配的肽段,得到每个样品鉴定到的肽段和蛋白结果。通常CoIP-MS是将IgG组及IP同时进行质谱鉴定,得到的反应两组蛋白差异的韦恩图。
5. 鉴定蛋白功能注释
对鉴定到的蛋白质进行GO、COG和KEGG注释分析,以预测蛋白质的功能,揭示蛋白质在各个生命活动中的生物学意义。其中,GO分析总共有三个本体(ontology),分别描述基因的分子功能(molecular function)、细胞组分(cellular component)、参与的生物过程(biological process);COG是对蛋白质进行直系同源分类的数据库;KEGG是有关Pathway的主要公共数据库,通过Pathway分析能确定蛋白质参与的最主要生化代谢途径和信号转导途径。
由于一些样本中目的蛋白含量本身不高,同时其互作蛋白、互作复合体存在的丰度则进一步降低,因而CoIP-MS需要保证样品充足的上样量(动物细胞2-10 x 107,植物组织1-3g)。一些细胞模型需要预先进行条件刺激或者基因表达干预,金开瑞生物除了可以进行细胞培养、条件刺激(包括加药、缺氧等条件),还能先构建稳定细胞株作为样本CoIP-MS实验。因为在本身实验需要细胞量较大的情况下,进行瞬时转染不仅一次上机便会消耗大量转染试剂导致成本不菲、同时其过表达/敲降效率还无法稳定,所以先构建稳定细胞株成为一种不错的途径。
相关技术服务