技术专题
光动力人工细胞器促进ATP合成并能够维持个体生命
文章来源:genecreate
作者:genecreate
发布时间:2018-12-20 17:19
题目:Photo-Powered Artificial Organelles for ATP Generation and Life-Sustainment
光动力人工细胞器促进ATP合成并能够维持个体生命
期刊:Advanced Materials
影响因子:21.950
合作技术:Label-free
研究背景
作为生命形式的细胞内能量转移 “货币分子单位”——三磷酸腺苷(ATP)几乎是所有生命形式中驱动细胞内生化反应最重要的直接能量来源。ATP生成过程中功能障碍会导致严重疾病,如身体衰老、线粒体疾病等。然而,迄今为止,生命中可控制的ATP生成仍然是一个未实现的目标。有效的替代能源供应系统能减少线粒体中的代谢应激,并有助于抗衰老和寿命延长。
研究结果
受植物光合作用启发,作者提出并构建了一种高效生命支持细胞内光学驱动系统(HELIOS)。在该系统中,将菠菜类囊体片段与磷酸胆碱和胆甾醇重新组合,合成一种蛋白质脂质体纳米颗粒结构。该系统能够产生胞质电子,在光照下可以显著提高细胞内ATP水平。为了研究HELIOS联合光照射是否能提高ATP水平和生物活性,作者选择了小鼠心脏和斑马鱼分别作为体内模型和体外模型进行实验研究(图1a)。
通过透射电镜(TEM)、动态光散射(图1b)和扫描电镜,作者测定合成的HELIOS纳米颗粒的平均粒径为75nm。根据TEM EDX图谱结果(图1c),Mg均匀分布于颗粒之间,证明光合蛋白和脂质体成功结合。随后,作者通过Label-Free定量蛋白质组技术,在HELIOS COS7细胞中共鉴定到1206种蛋白质(图1d-e,图2,图3),其中三分之二与叶绿体有关(图1e)。作者对23种光合蛋白进行深入分析,发现HELIOS颗粒中光合蛋白显著富集(图1f)。在模拟的细胞内环境中,观察到光系统I的抑制剂(diquat dibromide, oxyfluorofen)和光系统II的抑制剂(fluorodifen, atrazine)可以抑制HELIOS ATP的生成(图1g),类囊体解偶联剂(nitrofen, perfluidone) 对HELIOS ATP生成的影响较小。这些结果表明,HELIOS的工作机制与类囊体相似,但并不完全相同。
那么HELIOS在光照射下是否能够提高细胞内ATP浓度呢?经过一系列的优化实验,作者发现0.235 mg L−1 HELIOS在红光(18 W)照射30分钟的条件下,可以将COS7细胞内ATP水平提高2.45倍。为了证明HELIOS的通用性,作者又使用了其它几种哺乳动物细胞,包括上皮细胞(HLEC, COS7, HEK-293)、癌细胞(HeLa, B16, 4T1, CT26, EMT-6, MCF-7)、免疫细胞(RAW)、成纤维细胞(3T3)、心肌细胞(myocal cells),在与HELIOS孵育并照射红光的每个细胞系中,ATP水平均有增强。相较于无光照对照组,光照射组ATP浓度提高1.38-2.45倍(图1h),说明HELIOS可以促进ATP的合成并不是在某个细胞内的特定过程,而是在各种细胞中普遍适用的途径。
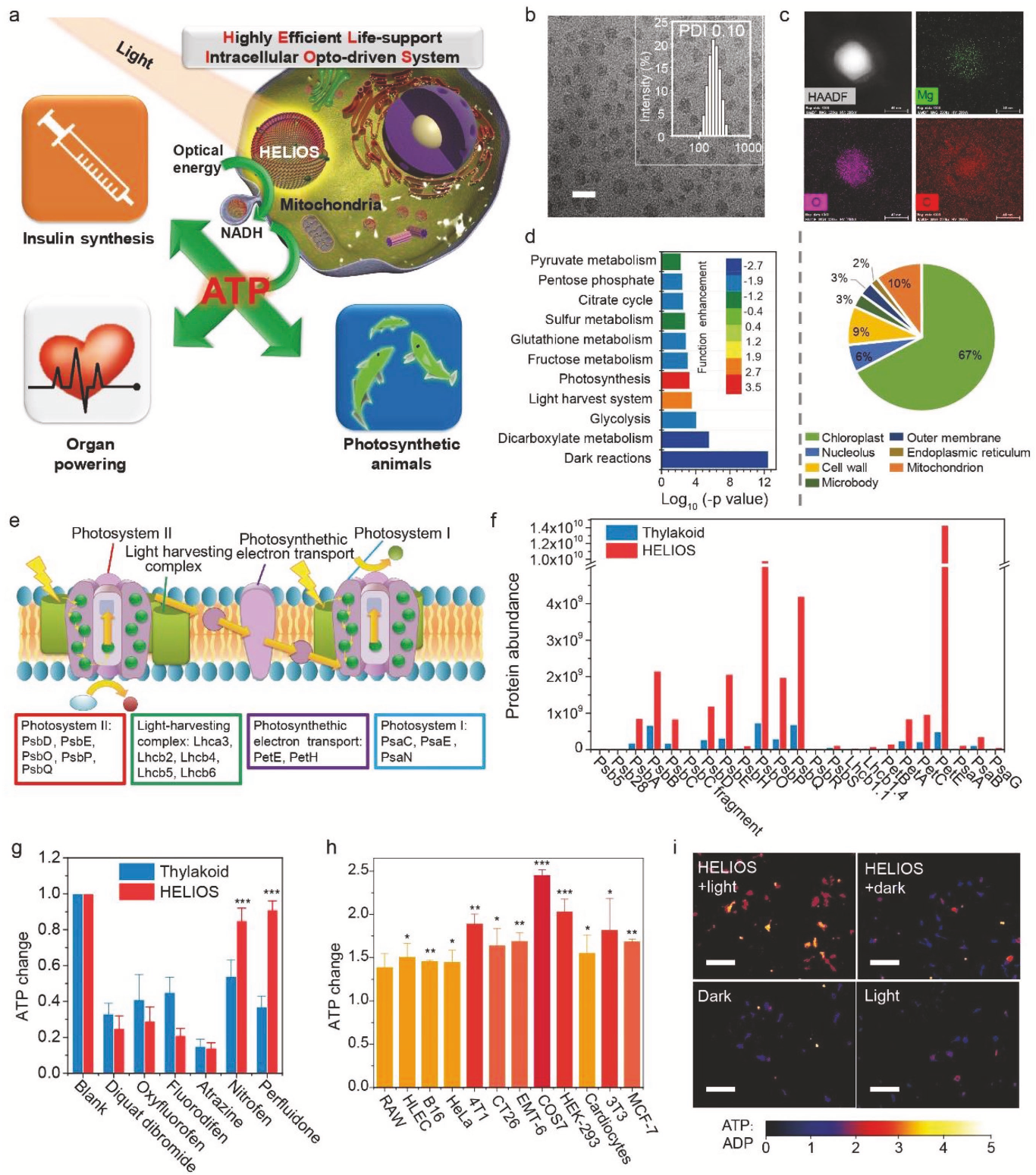
图1 HELIOS系统构建及表征
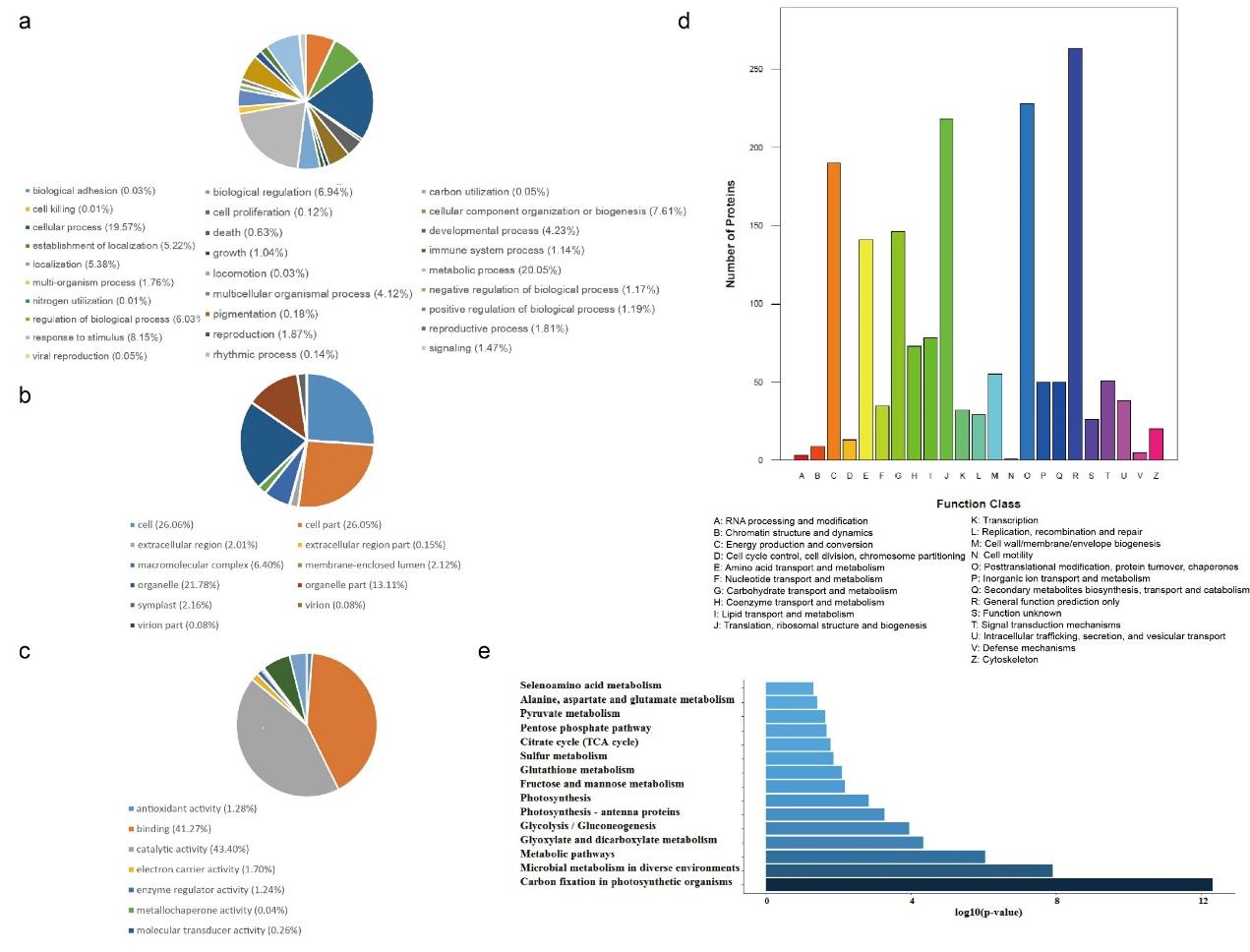
图2 HELIOS系统蛋白质组学分析
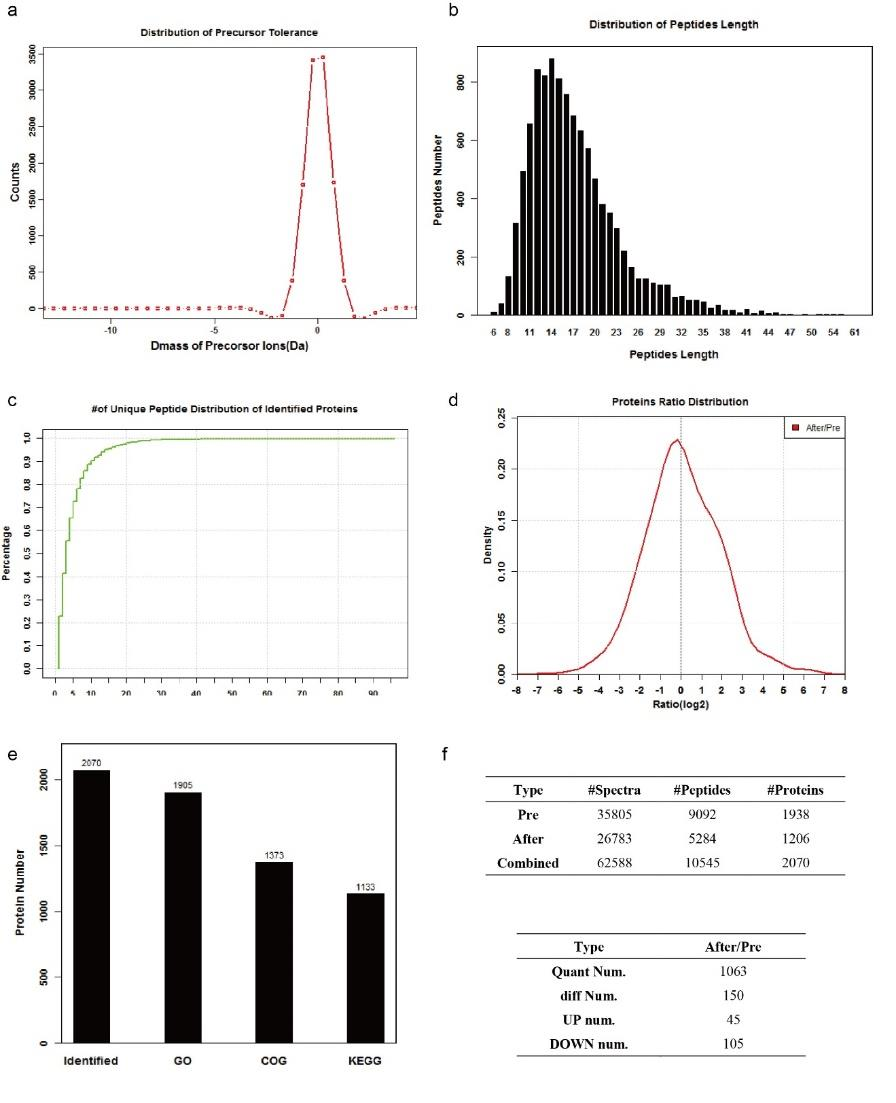
图3 HELIOS系统蛋白质LC-MS/MS分析
体外环境中,HELIOS系统并不能将ADP转化为ATP,因此,作者又验证了是否有内源性线粒体参与了ATP生成的改良过程。作者利用细菌内外膜泡(ISO)刺激线粒体的电子传递链,发现直接混合ISO、HELIOS和ADP不会产生任何多余的ATP(图4a)。进一步加入水溶性电子受体NAD+可以显著提高ATP的生成能力。因此,作者认为HELIOS负责将光子传递给电子,然后将电子传递给ISO产生ATP。此外,化学合成的半导体碳氮化物在光辐照射下能够产生光电子,也可以增强ISO的ATP生成。
如图4b所示,利用HELIOS产生的NADPH来增强线粒体ATP的合成,多余的NADPH需要通过转氢酶转化为NADH。作者发现在添加2,3-丁二酮(质子转移转糖激酶抑制剂)后可以显著抑制HELIOS的效率,糖酵解抑制剂2-脱氧-d -葡萄糖(2-DG)的添加并不影响HELIOS产生ATP的能力。有趣的是,虽然NADH的氧化并不发生在TCA循环中,但发现TCA循环的抑制剂乙酸氟(FA)会切断HELIOS细胞的能量供应。因此,作者推测TCA循环的一些中间产物可能参与了胞质选择性向线粒体的转运,利用TCA循环的中间产物作为载体进行电子迁移的生化系统MAS可能参与了这一过程。此外,作者认为HELIOS介导的ATP生成依赖于氧化磷酸化过程中NADH的消耗。添加氧化磷酸化抑制剂鱼藤酮(ROT)后,ATP生成显著下降。综上所述,通过MAS,细胞质内光照射HELIOS产生的NADH可以转移并用于线粒体的氧化磷酸化过程中,从而绕过糖酵解的TCA循环(图4c),而AOA(aminooxyacetate)的加入可以完全逆转HELIOS的作用。
为了更好地了解HELIOS对细胞代谢的影响,作者采用GC-MS法对128种差异代谢物进行代谢组学分析,发现HELIOS +光处理后的细胞代谢出现全面上调(图4d)。这说明ATP水平过高可能会改善细胞功能。此外,对代谢产物的层次聚类分析和主成分分析表明,HELIOS +光处理组细胞的代谢水平分别与磷酸盐缓冲盐水(PBS)和HELIOS +暗处理组相比有很大的差异。作者发现HELIOS +光处理对代谢((found: 515,total: 2045))和小分子转运(found: 92, total:430)的影响率分别为25.2%和21.4%(图4e)。此外,HELIOS可以显著增强丙酮酸代谢、TCA循环、碳水化合物代谢等ATP生成相关通路(图2f)和与氨基酸代谢、核苷酸生物合成、维生素代谢相关的上调通路,这些结果表明,HELIOS不仅可以促进ATP的生成,而且可以全面影响细胞的代谢。
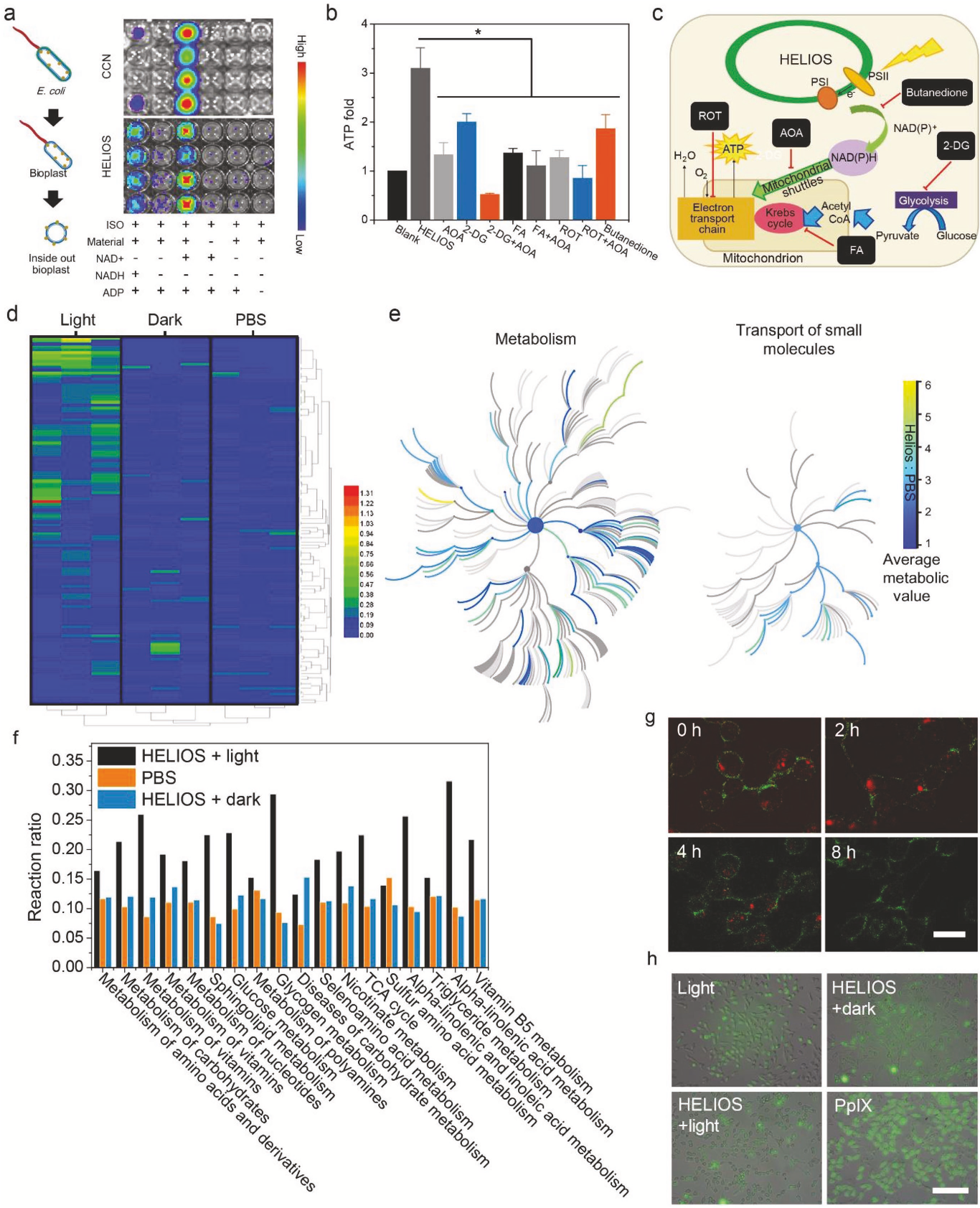
图4 HELIOS在动物细胞中的作用机制
接下来,作者又设计并进行了一系列的实验来验证HELIOS是否能够增强细胞、器官甚至个体的生物功能。作者首先研究了HELIOS对蛋白质生物合成过程的影响。通过利用绿色荧光蛋白(GFP)转染COS7细胞,研究HELIOS对哺乳动物细胞整体蛋白质生物合成的影响,发现经过HELIOS +光处理细胞的荧光强度显著提高2.6倍。为了观察HELIOS对细胞功能增强的影响,作者分离了原发性心肌细胞。心肌细胞自发搏动实际上是ATP消耗的敏感过程,因此,作者推测HELIOS可能能够以自养的方式维持心肌细胞的生物学功能(图5a)。在无糖培养基条件下培养心肌细胞12 h后,心肌细胞搏动频率从77.6 min−1 下降到18.6 min−1,而光+HELIOS心机细胞搏动频率维持在41.3 min−1(图5b),搏动幅度则是对照组的2.1倍。葡萄糖复苏后,光+HELIOS心机细胞搏动频率也显著高于对照组,这说明在经过光照处理的HELIOS心肌细胞中,ATP浓度明显升高(图5c)。
随后作者又将HELIOS系统作用到器官和个体模型上。通过建立大鼠缺血心脏模型,研究HELIOS能否在极端能量限制下对缺血心脏提供保护作用。发现HELIOS处理后大鼠缺血心脏可以显著降低血清肌酸激酶(CK)和乳酸脱氢酶(LDH)的增加,同时降低了TnT的生成。此外,作者还观察到心肌组织ATP水平升高,证实HELIOS具有心脏保护作用(图5d-f)。随后作者又构建了斑马鱼模型(图6a),发现在实验进行6d后,除少量的红色荧光由于摄食原因在仔鱼胃中积累外,大部分红色荧光均匀分布在仔鱼体内,包括眼睛和尾巴(图6b)。和对照组相比,HELIOS +光处理斑马鱼的平均体长略长,死亡率也较低。行为学实验发现,HELIOS +光处理的仔鱼呈现强健的运动活性(图6c),而在其他三个对照组中,超过85%的斑马鱼表现出游泳活动减少。这一结果不仅表明光照射在HELIOS支持的ATP合成过程中发挥了关键作用,还表明能量来源可能不是来自HELIOS的消化或吸收,而是来自HELIOS支持的“光合作用”。触觉反应实验表明,和对照组相比,实验组反应迅速,灵敏度高,平均移动距离长(图6d-e)。对各组鱼的ATP浓度分析发现,HELIOS +光照处理组的ATP和NADH生成量显著增加(图6f),这与游泳活动和触觉反应试验结果一致。为了排除环境因素可能的干扰,作者将HELIOS注射到斑马鱼体内,光照射后发现ATP水平增加1.4倍(图6g)。同时也证明HELIOS产生ATP的效率在活体动物中可以维持8小时(图6h)。HELIOS在体内应用过程中,氧化应激水平没有明显升高(图6i)。所有这些结果都证明HELIOS可用于脊椎动物中增强ATP生成,并在体内具有良好的保留能力(图6j)。
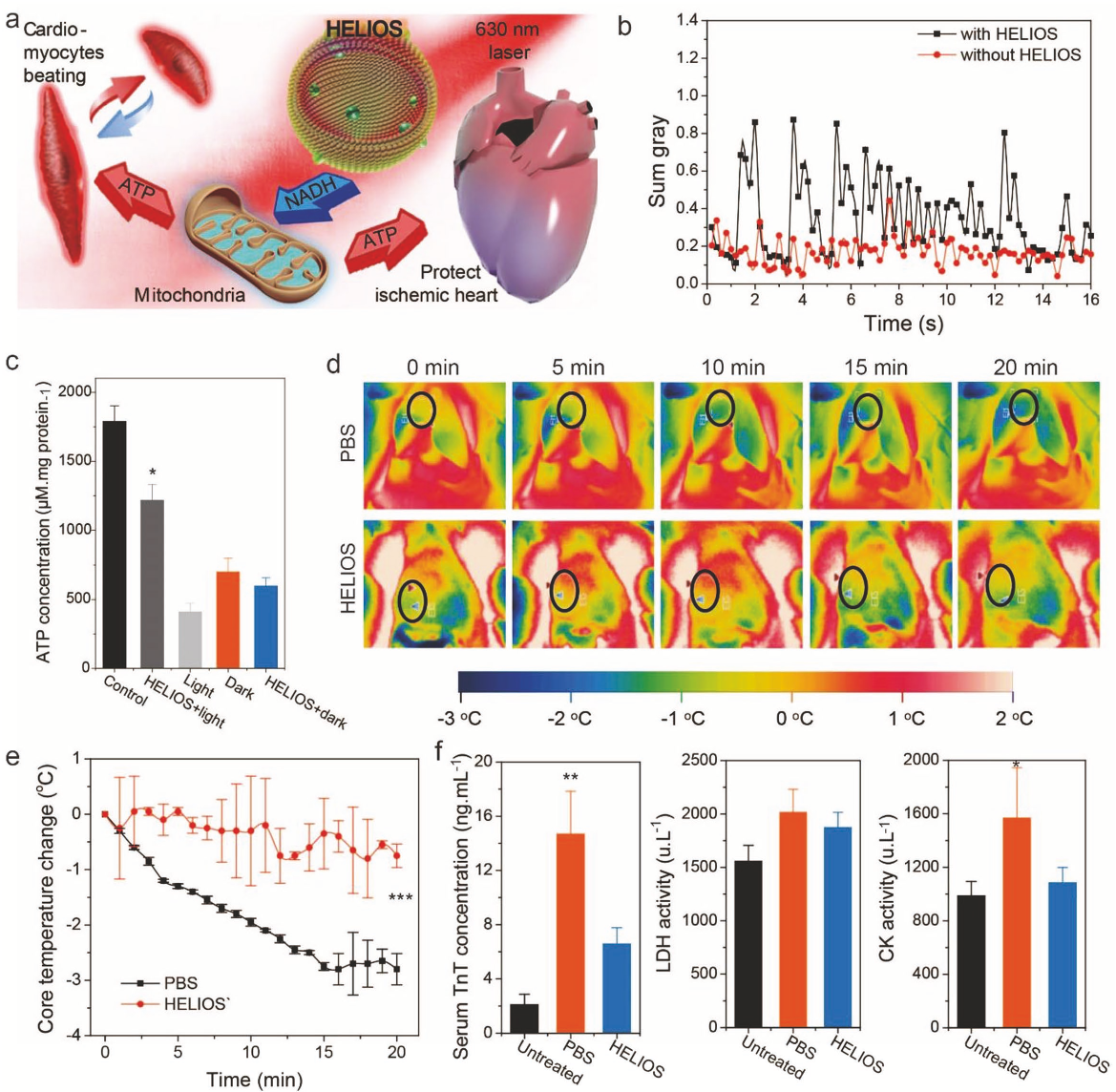
图5 HELIOS对心脏器官的影响
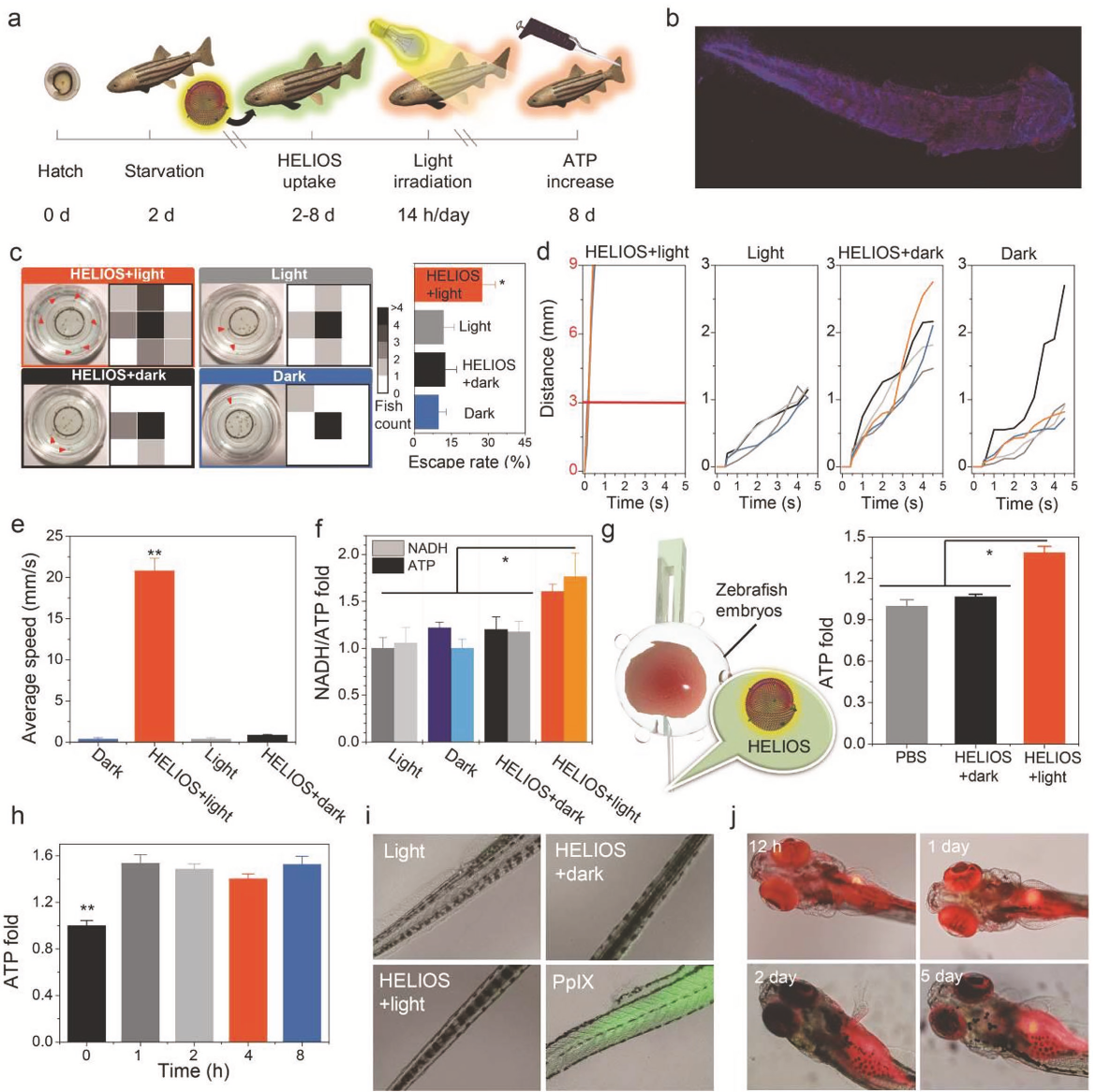
图6 HELIOS在斑马鱼体内的影响
研究结论
作者构建的HELIOS系统能够驱动ATP合成和维持细胞生理活性。在不同细胞系中,红光照射下加入HELIOS可以显著提高细胞内ATP的生成,同时还可以全面促进细胞功能,如荧光蛋白的合成、细胞运动、胰岛素分泌。在器官和个体层面,HELIOS可以从心肌梗塞中拯救小鼠心脏并维持禁食后的斑马鱼生命。光动力人工细胞器可以加深对新陈代谢的理解,并促进针对细胞内能量供应的光学疗法的发展。
解析文献
Di-Wei Zheng, Lu Xu, et al. Photo-Powered Artificial Organelles for ATP Generation and Life-Sustainment[J]. Advanced Materials, 2018, DOI: 10.1002/adma.201805038. 9.
相关服务
Label-free是通过比较质谱分析次数或质谱峰强度,分析不同来源样品蛋白的数量变化,认为肽段在质谱中被捕获检测的频率与其在混合物中的丰度成正相关。Label-free定量不需要对比较样本做特定标记处理,只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。
金开瑞提供的Label-free定量蛋白质组技术服务,已助力客户文献发表多篇文章,影响因子高达20+!
上一篇:病毒鉴定的方法有哪些?