技术专题
胶体金标记及应用
文章来源:genecreate
作者:genecreate
发布时间:2018-03-21 10:25
胶体金是氯金酸在还原剂的作用下,聚合成特定大小的金颗粒,并由于静电作用形成一种稳定的胶体状态,故称之为胶体金。胶体金溶液的常见制备方法大致分为白磷还原法、硼氢化钠还原法、抗坏血酸盐还原法、柠檬酸三钠还原法和鞣酸柠檬酸三钠还原法。其基本原理是向一定浓度的金溶液内加入适量还原剂,使金离子还原为金原子。通过改变反应体系中氯金酸与还原剂的比例可得到所需不同直径的金颗粒。
一. 胶体金标记
在碱性条件下,胶体金颗粒表面带负电荷,可与目标蛋白质所带正电荷基团之间形成非共价键的静电吸引而牢固结合,这种结合对所标蛋白的生物学活性无明显影响。吸附在胶体金表面的抗原或抗体能定向将胶体金颗粒载运到组织或细胞内、固相载体上相应抗体或抗原的位置。由于金颗粒具高电子密度的特性,这些标记物在抗原抗体反应处聚集达到一定密度时(即金颗粒107个/mm2),出现肉眼可见的粉红色斑点。
进行胶体金标记需要对pH环境、蛋白/抗体浓度、参数进行优化,采用的方法为浓度梯度法。
A 最适pH选择
pH是标记过程的关键决定因素,一般在蛋白/抗体等电点pI略偏碱性的环境下标记效果最好,可以采用加入0.1 M碳酸钾或者0.1 N盐酸的方法调节胶体金溶液的pH。同时,因为胶体金溶液可能损伤探头,所以常采用精密pH试纸进行pH测定。操作时将胶体金溶液调节到3~10八个pH梯度,加入被标记的蛋白/抗体,混合后室温放置15 min,再加入10%氯化钠室温放置15 min,记录保持红色的最低pH,记为pH0;然后设置pH梯度为pH0-0.6、pH0-0.3、pH0、pH0+0.3、pH0+0.6、pH0+1,重复前面的操作,直到找到室温放置2 h仍保持红色的最低pH。
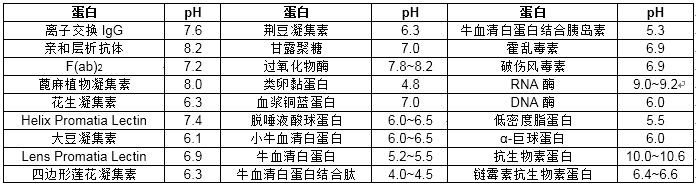
一般我们标记抗体IgG最适pH在9.0,单克隆抗体在8.2,SPA(proteinA)在5.9-6.2,其他常用的蛋白标记pH见下表:
一. 胶体金标记
在碱性条件下,胶体金颗粒表面带负电荷,可与目标蛋白质所带正电荷基团之间形成非共价键的静电吸引而牢固结合,这种结合对所标蛋白的生物学活性无明显影响。吸附在胶体金表面的抗原或抗体能定向将胶体金颗粒载运到组织或细胞内、固相载体上相应抗体或抗原的位置。由于金颗粒具高电子密度的特性,这些标记物在抗原抗体反应处聚集达到一定密度时(即金颗粒107个/mm2),出现肉眼可见的粉红色斑点。
进行胶体金标记需要对pH环境、蛋白/抗体浓度、参数进行优化,采用的方法为浓度梯度法。
A 最适pH选择
pH是标记过程的关键决定因素,一般在蛋白/抗体等电点pI略偏碱性的环境下标记效果最好,可以采用加入0.1 M碳酸钾或者0.1 N盐酸的方法调节胶体金溶液的pH。同时,因为胶体金溶液可能损伤探头,所以常采用精密pH试纸进行pH测定。操作时将胶体金溶液调节到3~10八个pH梯度,加入被标记的蛋白/抗体,混合后室温放置15 min,再加入10%氯化钠室温放置15 min,记录保持红色的最低pH,记为pH0;然后设置pH梯度为pH0-0.6、pH0-0.3、pH0、pH0+0.3、pH0+0.6、pH0+1,重复前面的操作,直到找到室温放置2 h仍保持红色的最低pH。
一般我们标记抗体IgG最适pH在9.0,单克隆抗体在8.2,SPA(proteinA)在5.9-6.2,其他常用的蛋白标记pH见下表:
B 蛋白浓度优化
优化了pH值后,继续优化标记的最低蛋白/抗体浓度,也是采用梯度法,用不同浓度蛋白/抗体溶液与胶体金(已处于最佳pH环境)溶液混合后室温放置15 min,加入10%氯化钠室温放置2 h,测定OD520~580,以吸光值对蛋白/抗体浓度作图,取线性趋势线与横轴交点的蛋白/抗体浓度为最小蛋白/抗体浓度。
确定了最适pH及最小蛋白/抗体浓度后,可以开始进行金标记了。在调节好pH的胶体金溶液中边迅速搅拌边逐滴加入蛋白/抗体(浓度是之前确定的最小值的1.2倍),5min内加完,再加入10% BSA至BSA终浓度为1%,搅拌10 min。低温超速离心去除未标记蛋白/抗体及未充分标记的胶体金,具体方法可参考:先1500 rpm低速离心1 h去掉沉淀,然后15000 rpm离心1 h去掉上清,沉淀用含1% BSA的TBS溶解,重复高速离心三遍,得到可用于试纸条制备的金标蛋白/抗体溶液。
C参数优化
样品垫与金标垫的组合优化
样品垫处理液的pH设置三个梯度(7.2、8.0、9.0),金标蛋白/抗体溶液设置三个稀释倍数(1:1、1:2、1:3)制成金标垫,交叉组合观察加入阳性、阴性对照(生理盐水)后的显色情况(T线和C线均以1 mg/mL的浓度包被)。
优化了pH值后,继续优化标记的最低蛋白/抗体浓度,也是采用梯度法,用不同浓度蛋白/抗体溶液与胶体金(已处于最佳pH环境)溶液混合后室温放置15 min,加入10%氯化钠室温放置2 h,测定OD520~580,以吸光值对蛋白/抗体浓度作图,取线性趋势线与横轴交点的蛋白/抗体浓度为最小蛋白/抗体浓度。
确定了最适pH及最小蛋白/抗体浓度后,可以开始进行金标记了。在调节好pH的胶体金溶液中边迅速搅拌边逐滴加入蛋白/抗体(浓度是之前确定的最小值的1.2倍),5min内加完,再加入10% BSA至BSA终浓度为1%,搅拌10 min。低温超速离心去除未标记蛋白/抗体及未充分标记的胶体金,具体方法可参考:先1500 rpm低速离心1 h去掉沉淀,然后15000 rpm离心1 h去掉上清,沉淀用含1% BSA的TBS溶解,重复高速离心三遍,得到可用于试纸条制备的金标蛋白/抗体溶液。
C参数优化
样品垫与金标垫的组合优化
样品垫处理液的pH设置三个梯度(7.2、8.0、9.0),金标蛋白/抗体溶液设置三个稀释倍数(1:1、1:2、1:3)制成金标垫,交叉组合观察加入阳性、阴性对照(生理盐水)后的显色情况(T线和C线均以1 mg/mL的浓度包被)。

这里主要是对样品垫处理液pH及金标物质的浓度进行优化,另外我们也可以对样品垫和金标垫的处理液成分进行优化,这需要设计各种组合进行测试。
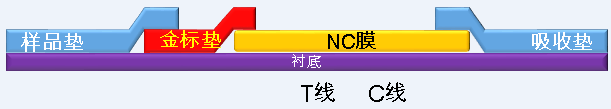
T线、C线包被浓度优化
将要包被的抗体进行1:1、1:2、1:3的稀释,包被NC膜后经阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳稀释倍数(浓度)。
将要包被的抗原进行1:10、1:20、1:40、1:50、1:100的稀释,抗体浓度采用上一步优化的浓度,包被NC膜,经阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳稀释倍数(浓度)。
当然,我们也可以采用组合试验进行二者包被浓度的优化。
检测垫封闭时间优化
检测垫封闭时间设定1 h、0.5 h、1 h、2 h四个梯度,用之前优化的参数组装试纸条,加入阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳封闭时间。同时,我们也可以对BSA的浓度进行优化,以及对包被物质的选择进行优化,或者进行多个参数的组合优化。
二.免疫胶体金标记技术的应用
早期免疫胶体金标记技术主要应用于光学显微镜观察细胞表面抗原进行组化研究,但因灵敏度低而受到限制,IGSS创立以后免疫金标记技术得到了广泛应用。目前,免疫胶体金标记技术在组化中的应用已日趋普遍,胶体金探针的种类也越来越多。由于胶体金的高电子密度使其在电镜下清晰可辨,因此该技术进一步在电镜上使用,由对组织细胞定位研究,进一步深入到了基因转录水平、基因表达的检测、染色体的基因定位、特定核酸序列在细胞内的空间分布分析及核酸复制过程中的定性与定量分析等。
将要包被的抗体进行1:1、1:2、1:3的稀释,包被NC膜后经阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳稀释倍数(浓度)。
将要包被的抗原进行1:10、1:20、1:40、1:50、1:100的稀释,抗体浓度采用上一步优化的浓度,包被NC膜,经阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳稀释倍数(浓度)。
当然,我们也可以采用组合试验进行二者包被浓度的优化。
检测垫封闭时间优化
检测垫封闭时间设定1 h、0.5 h、1 h、2 h四个梯度,用之前优化的参数组装试纸条,加入阳性、阴性对照(生理盐水)检测观察显色情况,选择最佳封闭时间。同时,我们也可以对BSA的浓度进行优化,以及对包被物质的选择进行优化,或者进行多个参数的组合优化。
二.免疫胶体金标记技术的应用
早期免疫胶体金标记技术主要应用于光学显微镜观察细胞表面抗原进行组化研究,但因灵敏度低而受到限制,IGSS创立以后免疫金标记技术得到了广泛应用。目前,免疫胶体金标记技术在组化中的应用已日趋普遍,胶体金探针的种类也越来越多。由于胶体金的高电子密度使其在电镜下清晰可辨,因此该技术进一步在电镜上使用,由对组织细胞定位研究,进一步深入到了基因转录水平、基因表达的检测、染色体的基因定位、特定核酸序列在细胞内的空间分布分析及核酸复制过程中的定性与定量分析等。